 Sammeln wir mal zusammen, was wir für das Verständnis von der Entstehung von Farben benötigen. Wir brauchen den Welle-Teilchen-Dualismus und eine moderne Ansicht vom Aufbau von Atomen. Sicherlich ist der Begriff des Photons geläufig. Das ist das "Teilchen", was mit Licht in Verbindung gebracht wird. Mit den Augen der klassischen Physik betrachtet, wird klar, wie der photoelektrische Effekt funktioniert. Schließlich hat unser Physiklehrer uns eingebläut, dass eine Welle keine Materie transportieren kann, wie sollte sonst Licht dann elektrische Ladungen freisetzen, wie es in Solarzellen geschieht. Also muss Licht aus Teilchen bestehen! Oder?
Sammeln wir mal zusammen, was wir für das Verständnis von der Entstehung von Farben benötigen. Wir brauchen den Welle-Teilchen-Dualismus und eine moderne Ansicht vom Aufbau von Atomen. Sicherlich ist der Begriff des Photons geläufig. Das ist das "Teilchen", was mit Licht in Verbindung gebracht wird. Mit den Augen der klassischen Physik betrachtet, wird klar, wie der photoelektrische Effekt funktioniert. Schließlich hat unser Physiklehrer uns eingebläut, dass eine Welle keine Materie transportieren kann, wie sollte sonst Licht dann elektrische Ladungen freisetzen, wie es in Solarzellen geschieht. Also muss Licht aus Teilchen bestehen! Oder?
Licht sind Teilchen? Wenn dem so wäre, würden nur zwei Linien an der Wand zu sehen sein, wenn wir eine Taschenlampe auf einen Doppelspalt richten. Aber wir sehen viele Linien an der Wand (siehe Bild oben). Also muss doch mehr dahinter stecken. Beugung tritt ja eigentlich nur bei Wellen auf. Also doch Welle und gleichzeitig Teilchen? Weil sich das doch sehr schwer vorstellen läßt, dass etwas ein Teilchen sein kann, aber auch eine Welle, gibt es ein kleines Gedankenexperiment. Stellen wir uns also eine Person vor, die im 2-dimensionalen Raum lebt, also nur Höhe und Breite kennt. Wie würde diese Person reagieren, wenn wir sie mit einem Zylinder konfrontieren. Betrachten wir den Zylinder von oben, hat er den Querschnitt eines Kreises und von vorn gesehen, wirkt der Zylinder wie ein Rechteck. Und genauso würde ihn die 2-dimensionale Person wahrnehmen, je nachdem welchen Querschnitt sie sieht. Für sie wäre es kaum vorstellbar, dass es sich bei Kreis und Rechteck um ein und denselben Körper handelt. Na, klingelt es?
 Setzen wir unsere Reise durch die wunderbare Welt der Atome fort. Natürlich haben sich die Wissenschaftler einige Gedanken gemacht. Ich hoffe, aus der Schulbildung ist noch hängengeblieben, dass Atome aus Protonen, Neutronen und Elektronen bestehen?! Die ersten Atommodelle sahen die ganzen Teilchen nebeneinander umherschwirren. Bis ein Herr Rutherford folgendes Experiment machte: Er nahm eine hauchdünne Goldfolie und hat sie mit Teilchen (alpha-Strahlung) beschossen. Und was mußte Rutherford feststellen: Die Teilchen passierten die Folie ungehindert und wurden nur gelegentlich abgelenkt. Also konnten die Protonen, Neutronen und Elektronen nicht gleichmäßig verteilt sein. Er schlußfolgerte, dass die Protonen und Neutronen den Atomkern bilden und die Elektronen diesen mit hohem Tempo umkreisen. Nur mal zum Vergleich: Der Atomkern ist ca. 1 x 10-15 Meter im Durchmesser, während das gesamte Atom zwischen 100 und 400 x 10-12 Meter einnimmt, was dann mehr als das 100.000-fache der Größe des Atomkerns entspricht. Auch wenn das nicht dazugehört, besteht doch ein Atom im wesentlichen aus Nichts.
Setzen wir unsere Reise durch die wunderbare Welt der Atome fort. Natürlich haben sich die Wissenschaftler einige Gedanken gemacht. Ich hoffe, aus der Schulbildung ist noch hängengeblieben, dass Atome aus Protonen, Neutronen und Elektronen bestehen?! Die ersten Atommodelle sahen die ganzen Teilchen nebeneinander umherschwirren. Bis ein Herr Rutherford folgendes Experiment machte: Er nahm eine hauchdünne Goldfolie und hat sie mit Teilchen (alpha-Strahlung) beschossen. Und was mußte Rutherford feststellen: Die Teilchen passierten die Folie ungehindert und wurden nur gelegentlich abgelenkt. Also konnten die Protonen, Neutronen und Elektronen nicht gleichmäßig verteilt sein. Er schlußfolgerte, dass die Protonen und Neutronen den Atomkern bilden und die Elektronen diesen mit hohem Tempo umkreisen. Nur mal zum Vergleich: Der Atomkern ist ca. 1 x 10-15 Meter im Durchmesser, während das gesamte Atom zwischen 100 und 400 x 10-12 Meter einnimmt, was dann mehr als das 100.000-fache der Größe des Atomkerns entspricht. Auch wenn das nicht dazugehört, besteht doch ein Atom im wesentlichen aus Nichts.
 Niels Bohr, der sich einen Namen bei der Entwicklung zur Quantentheorie gemacht hat, bemerkte dann, dass doch bei dem Modell von Rutherford was nicht stimmt. Vielleicht erinnert sich der eine oder andere an das Experiment im Physikunterricht. Der Versuchsaufbau war folgender: Ein Elektromagnet (nach Möglichkeit in Stabform) und ein Metallring, der um den Magenten gelegt wurde. Schaltete man den Elektromagneten ein, flog der Ring weg. Was war also passiert? Bewegte Ladungen erzeugen ein Magnetfeld und umgekehrt. Der Elektromagnet hat also die Elektronen in dem Ring auf Trab gebracht, die wiederum ein Magnetfeld erzeugt haben. Beide stoßen sich ab und der Ring ist derjenige, dem das Entweichen am besten möglich ist. Nach Rutherford bewegen sich die Elektronen ständig um den Kern und erzeugen demzufolge immer ein elektromagnetisches Feld. Da das natürlich nicht ohne Energieverlust geht, müßten die Elektronen ständig Energie verlieren und würden früher oder später in den Kern stürzen. Also schuf er zwei Annahmen: zum einen, gibt es Bahnen um den Atomkern, wo sich Elektronen aufhalten können, ohne Energie zu verlieren und zum zweiten, dass ein Bahnwechsel nur möglich ist, wenn ein Elektron Energie in einer bestimmten Menge aufnimmt oder abgibt.
Niels Bohr, der sich einen Namen bei der Entwicklung zur Quantentheorie gemacht hat, bemerkte dann, dass doch bei dem Modell von Rutherford was nicht stimmt. Vielleicht erinnert sich der eine oder andere an das Experiment im Physikunterricht. Der Versuchsaufbau war folgender: Ein Elektromagnet (nach Möglichkeit in Stabform) und ein Metallring, der um den Magenten gelegt wurde. Schaltete man den Elektromagneten ein, flog der Ring weg. Was war also passiert? Bewegte Ladungen erzeugen ein Magnetfeld und umgekehrt. Der Elektromagnet hat also die Elektronen in dem Ring auf Trab gebracht, die wiederum ein Magnetfeld erzeugt haben. Beide stoßen sich ab und der Ring ist derjenige, dem das Entweichen am besten möglich ist. Nach Rutherford bewegen sich die Elektronen ständig um den Kern und erzeugen demzufolge immer ein elektromagnetisches Feld. Da das natürlich nicht ohne Energieverlust geht, müßten die Elektronen ständig Energie verlieren und würden früher oder später in den Kern stürzen. Also schuf er zwei Annahmen: zum einen, gibt es Bahnen um den Atomkern, wo sich Elektronen aufhalten können, ohne Energie zu verlieren und zum zweiten, dass ein Bahnwechsel nur möglich ist, wenn ein Elektron Energie in einer bestimmten Menge aufnimmt oder abgibt.
Damit hätten wir unser Ziel fast erreicht. Denn diese "Energiepakete", die ein Elektron aufnehmen und abgeben kann, sind die "Lichtteilchen" oder korrekter Lichtquanten. Und nun kam ein österreichischer Physiker daher und stellte fest, dass man Ort und Impuls eines Elektrons nie genau bestimmen kann, sondern nur eine Wahrscheinlichkeitsgleichung aufstellen kann, wo sich das Elektron mit höchster Wahrscheinlichkeit aufhält. Er faßte das natürlich allgemeiner, damit es für alle Quantensysteme gilt und die Formel wurde nach ihm benannt: die Schrödingergleichung. Wenn wir vom einfachsten Atom – dem Wasserstoffatom – ausgehen, dann wissen wir, dass es dort ein Elektron gibt, was um den Atomkern schwirrt. Die höchste Wahrscheinlichkeit, an welchen Positionen sich das Elektron in seinem optimalen Zustand (dazu später) aufhalten kann, ergibt eine Kugel. Diese Kugel nennt man Orbital. Beim Helium, wo es zwei Elektronen gibt, findet noch ein zweites Elektron in diesem Orbital Platz. Denn jedes Orbital kann nur zwei Elektronen aufnehmen. Abhängig ist das vom Drehimpuls des Elektrons, den man sich vereinfacht als Drehung des Elektrons vorstellen kann.
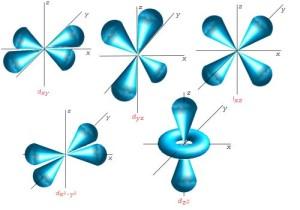 Ich muss jetzt wieder ein bißchen im Schulwissen stochern, denn wer sich noch an das Schalenmodell der Chemie und den Begriff Valenzelektronen erinnern kann, ist schon mal gut dran. Vielleicht als kleine Erinnerung: auf die 1. Schale passten zwei Elektronen, auf die 2. Schale acht Elektronen usw… Elemente mit vollbesetzten Elektronenschalen sind die allseits bekannten Edelgase. Dabei besteht jede dieser Schalen aus einem oder mehreren Orbitalen. Wie bereits oben beschrieben, ist das einfachste Orbital kugelförmig. Für alle weiteren Schalen kommen weitere Orbitale hinzu, die sich dann unterschiedlich im Raum anordnen. Mit steigender Schalenanzahl steigt auch die Anzahl der Orbitale, deren Form immer komplexer wird.
Ich muss jetzt wieder ein bißchen im Schulwissen stochern, denn wer sich noch an das Schalenmodell der Chemie und den Begriff Valenzelektronen erinnern kann, ist schon mal gut dran. Vielleicht als kleine Erinnerung: auf die 1. Schale passten zwei Elektronen, auf die 2. Schale acht Elektronen usw… Elemente mit vollbesetzten Elektronenschalen sind die allseits bekannten Edelgase. Dabei besteht jede dieser Schalen aus einem oder mehreren Orbitalen. Wie bereits oben beschrieben, ist das einfachste Orbital kugelförmig. Für alle weiteren Schalen kommen weitere Orbitale hinzu, die sich dann unterschiedlich im Raum anordnen. Mit steigender Schalenanzahl steigt auch die Anzahl der Orbitale, deren Form immer komplexer wird.
Auch wenn es jetzt ein wenig durcheinander ging, kommt jetzt der große Aha-Effekt, denn die Elektronenschalen entsprechen der Hauptquantenzahl, die Nebenquantenzahl gibt an, in welchem Orbital sich das Elektron aufhält, die Magnetquantenzahl, wie sich das Orbital räumlich ausrichtet und letztendlich die Spinquantenzahl, um den "Eigendrehimpuls" des Elektrons anzugeben. Mit Hilfe dieser vier Quantenzahlen können wird genau sagen, von welchem Elektron wir sprechen und mit dem Wissen können wir jetzt Farben erklären. Aber nur für einfache Atome, denn der Wirrwarr mit den ganzen Orbitalen wird bei Molekülen so komplex, dass man die Gleichung für die Aufenthaltswahrscheinlichkeit garnicht mehr mit mathematischen Mitteln darstellen kann und sich auf den Computer verlassen muss, dass der mittels numerischer Methoden alles korrekt berechnet.
Ein Elektron hat natürlich immer das Bestreben, dass tiefste nicht vollständig besetzte Orbital zu belegen. So ein Elektron kennt natürlich auch einen "angeregten" Zustand, d.h. es besitzt mehr Energie und befindet sich in einem höhergelegenen Orbital. Um diesen Zustand loszuwerden, gibt es Energie in Form eines Lichtquant ab und fällt auf das tiefstmögliche Orbital. Die Wellenlänge des freigesetzten Lichtquants wird dabei bestimmt, von welcher Elektronenschale das Elektron in welche fällt. Je "tiefer" es fällt, um so größer die freigesetzte Energie und desto kurzwelliger das Licht (d.h. höhere Frequenz). Und wie kann man das Freiwerden der Energie schöner sehen, als in den Spektrallinien. Umgekehrt lassen auch die Spektrallinien Rückschlüsse auf die chemische Bindung zu.
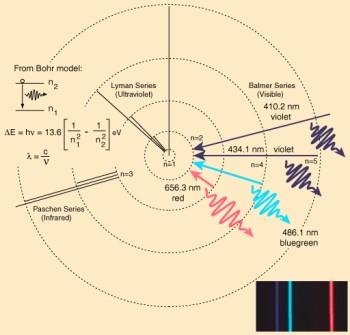
Interessant sich die Welt vorzustellen, wenn man weiß, dass dabei ständig Elektronen ihre Schalen wechseln, deren Sprünge wir als Farben wahrnehmen…

